中国农历新年临近,正在准备过新年的人们也越来越担心新出现的病毒的感染。近日,Science、Nature杂志相继在线发表评论,再次高度关注中国武汉发现的新型冠状病毒感染疫情。

图1(图片来源:nature)

图2 工作人员正在监视到达香港国际机场乘客的迹象。(图片来源:nature)
2019年12月31日:中国向世界卫生组织通报湖北武汉发现不明原因肺炎病例。
2020年1月9日:初步鉴定新型冠状病毒,随后将病毒基因序列向全球共享。
截至1月21日中午,中国境内累计报告新型冠状病毒感染的肺炎病例224例,其中确诊病例218例。北京、广东、上海先后出现确诊病例,四川、云南、广西、山东、湖南等地也出现疑似病例。在中国香港、日本、韩国和泰国有出口型病例。
图3 Science最新社论:中国报告武汉感染新冠状病毒200多例(2020-1-20,图片来源:Science)

图4 Nature社论:中国新型病毒的控制需要国际通力合作(2020-1-19,图片来源:Nature)

图5 Science社论:世界警惕中国可能发现新的SARS样新病毒(2020-1-14,图片来源:Science)

图6 Nature社论:中国新型病毒导致神秘肺炎(2020-1-08,图片来源:Nature)
武汉是中国中部的主要城市和旅游枢纽,感染爆发始于12月中旬,许多最初的患者曾在该市的华南海鲜批发市场(有1000多家商铺)工作或购物,那里的摊贩还出售活禽和其他动物(如野鸡、蛇、虎斑蛙),摊主和顾客都有机会接触野生动物携带的冠状病毒,这些冠状病毒通过变异获得感染人体的能力,成为全新品种,这为这种感染从动物传播到人类提供了契机。
1月8日,中国科学家确定冠状病毒家族的新成员可能是罪魁祸首并很快进行了测序并释放了其基因组,以方便全世界的科学家能够进行诊断测试。武汉CoV的代表基因组序列于2020年1月10日首次发布,随后又发布了另外五个武汉CoV的基因组序列。
当前的公共卫生突发事件部分类似于2002年在中国南部爆发的SARS疫情。这两次都是在冬季发生的,最初的病例与接触在动物市场上出售的活体动物有关,都是由以前未知的冠状病毒引起的。
结合之前发表在武汉病毒所发表在Nature Reviews Microbiology上题为Origin and evolution of pathogenic coronaviruses(致病性冠状病毒的起源和进化),以及1月21日《中国科学:生命科学》英文版发表的中科院、军事医学研究院的最新论文Evolution of the novel coronavirus from the ongoing Wuhan outbreakand modeling of its spike protein for risk of human transmission(武汉爆发的新型冠状病毒的进化及其对人类传播风险的刺突蛋白的建模),小编对致病性冠状病毒的起源进化进行了梳理。


(图7)(图8)
冠状病毒具有包膜,在系统分类上属冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus,CoV)。冠状病毒属的病毒是具外套膜(envelope)的正链单股RNA病毒,只感染人、鼠、猪、猫、犬、禽类脊椎动物。CoV基因组是正义单链RNA病毒,大小为27-32 kb,大小在所有RNA病毒基因组中排名第二。通常,基因组三分之二的RNA编码两个大的重叠多蛋白,它们被加工成病毒聚合酶(RdRp)和其他参与RNA合成或宿主反应调节的非结构蛋白。基因组的另外三分之一编码四种结构蛋白棘突(S),包膜(E),膜(M)和核衣壳(N)。
根据基因组序列的同源性,冠状病毒可分为4个属,α,β,γ和δ。γ和δ冠状病毒属只感染动物,α冠状病毒属包括人冠状病毒29E和NL63,β冠状病毒属包括4个家系,HKU1和OC43属于A家系;B家系包括SARS,与重症肺炎有关;MERS则属于β冠状病毒C家系。
严重急性呼吸系统综合症冠状病毒(SARS-CoV)和中东呼吸系统综合症冠状病毒(MERS-CoV)是21世纪初在人类中出现的两种高传播性和致病性病毒。SARS-CoV起源于中国,然后传播到世界其他地方,在2002-2003年大流行期间感染了大约8000人,总死亡率为10%;MERS-CoV自2012年在中东出现以来传播至27个国家,导致2249例确认感染病例,平均死亡率为35.5%。
除了这两种病毒外,α-CoV229E和NL63以及β-CoVOC43和HKU1也可以引起人类呼吸道疾病。而且,冠状病毒也会引起家畜和野生动物的大流行性疾病,如SADS-CoV被确认为是造成中国2万多头仔猪死亡的大规模爆发致命性疾病的病原体。
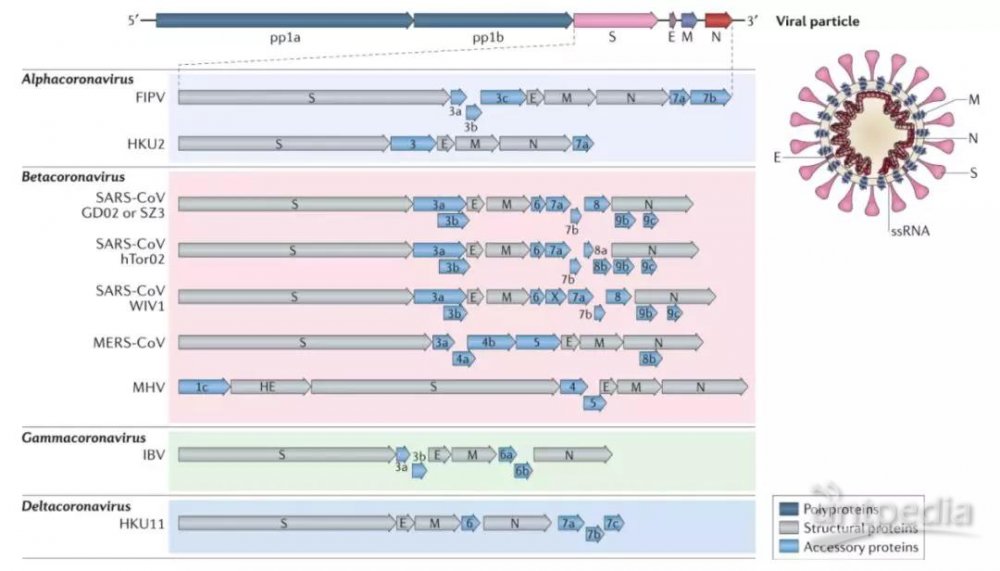
图9:不同冠状病毒的基因组,基因和蛋白组成(图片来源:Nature ReviewsMicrobiology)
冠状病毒可通过短距离飞沫、接触呼吸道分泌物等途径传播。人群普遍易感,医护人员更是高危人群。
不论是SARS还是中东呼吸综合征,蝙蝠都是重要的自然宿主,是最可能的传染源。比如,武汉病毒所已经确认SARS-CoV的自然宿主是中华菊头蝠,中东呼吸综合征MERS的病原体MERS-CoV,也是是经过蝙蝠到骆驼再到人的一个过程。
蝙蝠拥有大量高度多样化的冠状病毒,而且冠状病毒基因组在感染期间会定期重组,而丰富的冠状病毒基因库也会促进这一过程。其次,蝙蝠种类广泛分布并且生活在人类附近。广阔的疆域加上多样化的气候带来了巨大的生物多样性,大多数CoV可以在中国找到,可能会将病毒传播给人类和牲畜,包括蝙蝠和蝙蝠传播的病毒-ICTV冠状病毒的大多数物种(22/38)都是由研究蝙蝠或其他哺乳动物的中国科学家发现命名的。此外,中国的饮食文化认为,宰杀的活畜更具营养,这种信念也可能会增强病毒的传播。
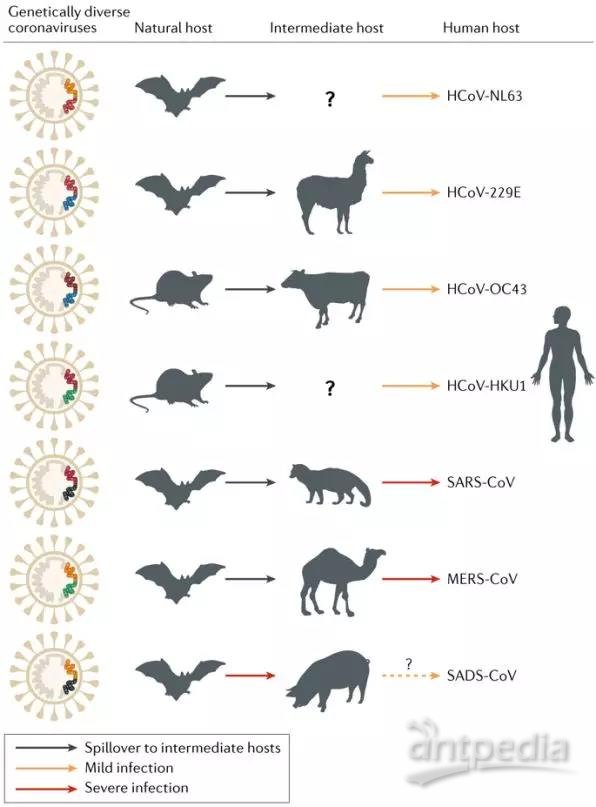
图10:人冠状病毒的动物起源。(图片来源:Nature Reviews Microbiology)
冠状病毒S蛋白的多样性高、机制复杂。S蛋白是病毒和人体细胞受体结合的桥梁,目前发现的6种冠状病毒,S蛋白以及在细胞表面和病毒蛋白结合的受体都各不相同;另外病毒可以产生micrRNA诱导T抗原表达的减低,改变宿主细胞状态以使感染细胞躲避T细胞的攻击,以利于病毒本身复制和存活。
武汉发现新型肺炎病例后,科学家从住院患者那里获得了病毒样本,当在室温下用电子显微镜检查观察时发现,分离的病毒在形态上以及病毒基因组的序列都几乎相同。研究发现,6个样品的武汉新型冠状病毒序列几乎完全一致,其与SARS的同源性更高(相似性约为70%),与MERS相似性约为40%。序列差异主要在ORF1a和编码S-蛋白的棘突基因上,这是冠状病毒与宿主细胞作用的关键蛋白。
为了了解武汉冠状病毒的起源及其与其他冠状病毒的遗传关系,科学家们对各种来源的冠状病毒序列的收集进行了系统发育分析。结果显示武汉冠状病毒聚集在系统发育树中,属于Betacoronavirus。Betacoronavirus可感染野生动物、畜群和人类,导致偶发性疾病爆发,并且常见感染中没有明显症状。武汉冠状病毒群位于SARS/SARS样冠状病毒群中,而蝙蝠冠状病毒HKU9-1是最近外类群。它与感染人类的冠状病毒SARS或SARS样冠状病毒在发育树上聚在一起,武汉冠状病毒与SARS/SARS样冠状病毒共享类似于蝙蝠冠状病毒HKU9-1的共同祖先。
蝙蝠很可能也是武汉冠状病毒的原生宿主,尽管从蝙蝠到人类的传播级联中仍然可能存在中间宿主,而且进化过程中频繁发生的重组事件可能会模糊其进化路径。
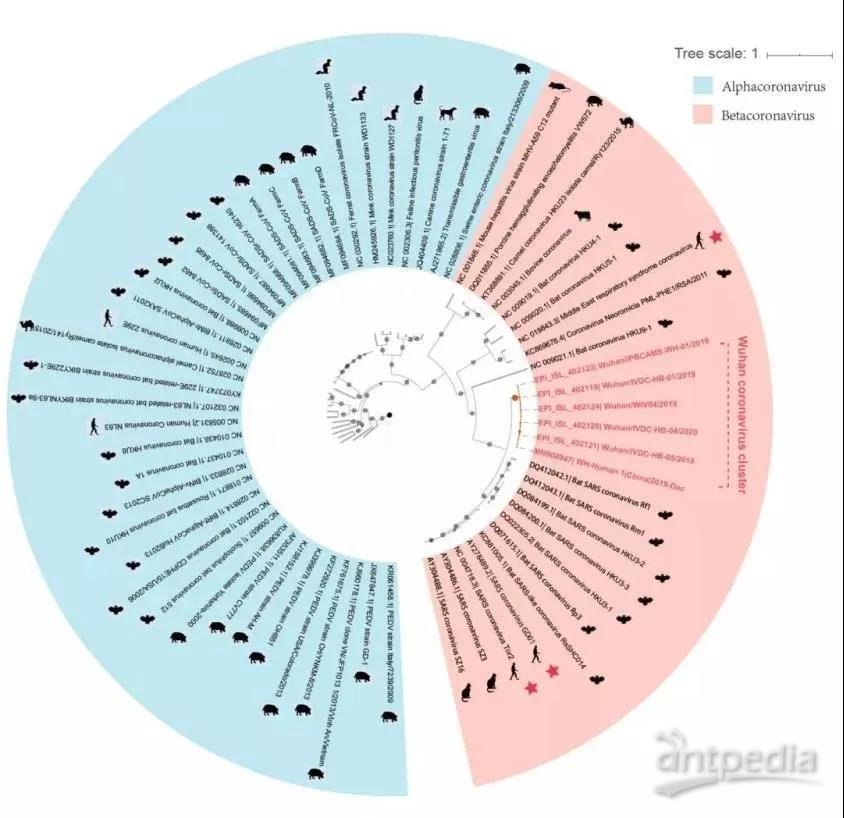
图11 基于全长基因组序列的冠状病毒的系统树(已知的人类感染性β-冠状病毒以红色星号表示)。(图片来源:SCIENCE CHINA LifeSciences)
总体而言,武汉冠状病毒与人类感染SARS-CoV之间存在相当大的遗传差异,而与MERS-CoV的差异更大。冠状病毒的S蛋白分为两个功能单元S1和S2。S1通过结合宿主受体促进病毒感染。它包含两个域,即与宿主受体直接相互作用的N端结构域和C端RBD结构域。
与冠状病毒的ORF1a和ORF1b相比,已知S蛋白通常具有最多的氨基酸序列。然而,尽管武汉冠状病毒S蛋白与SARS-CoV的总体同源性较低,但武汉冠状病毒S蛋白在RBD结构域中具有与该序列具有多个高度同源性的互补序列。
据报道,SARS-CoV的S蛋白中442、472、479、487和491位的残基位于受体复合物界面,被认为对SARS-CoV的跨物种和人际传播至关重要。尽管除了Tyr491,武汉冠状病毒S蛋白RBD结构域中高度保守的区域出现了替换,但置换氨基酸的极性和疏水性相似。此外,MERS-CoV S蛋白在RBD结构域中与SARS-CoV的同源性非常低,这是由于其S蛋白(人二肽基肽酶4)的结合靶点不同。
为了评估武汉冠状病毒人类传播的风险,科学家们对其S蛋白进行了结构建模,并评估了其与人类ACE2分子相互作用的能力。基于计算机指导的同源性建模方法,以SARS冠状病毒S蛋白(氨基酸序列同一性为76.47%)的晶体结构为模板构建了武汉冠状病毒S蛋白的结构模型。然后根据SARS-CoV S-蛋白RBD结构域与其受体ACE2复合的晶体结构,对武汉CoV S-蛋白与人ACE2结合的3-D复合结构进行建模及分子刚性对接。
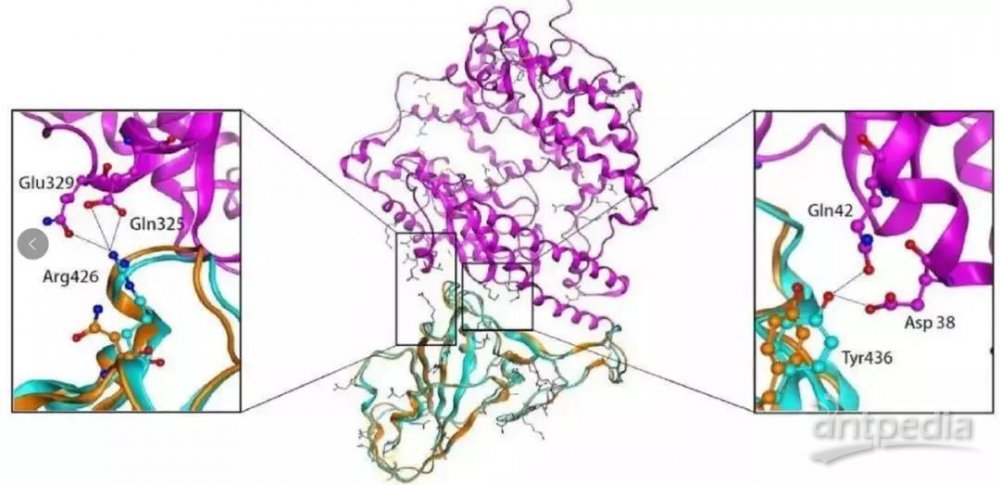
图12 新型冠状病毒的RBD结构域的关键氨基酸以及与人ACE2受体蛋白结合的预测模型(图片来源:SCIENCE CHINA Life Sciences)
武汉新型冠状病毒S-蛋白与人ACE2之间的结合自由能为-50.6 kcal/mol,比SARS的-78.6 kcal/mol 高28 kcal/mol。因此,尽管替换了五个重要的界面氨基酸残基中的四个,但武汉CoV S蛋白与人ACE2仍然具有显着的结合亲和力。
进一步观察发现,武汉CoV S蛋白中442、472、479和487位的替换残基没有改变整体结构。武汉冠状病毒S蛋白和SARS冠状病毒S蛋白在RBD结构域中共享几乎相同的3-D结构,因此在相互作用界面中保持相似的范德华力和静电性质。
武汉冠状病毒S蛋白的RBD结构域尽管与SARS-冠状病毒S蛋白具有序列多样性,但仍支持与人ACE2分子的强相互作用。因此,武汉冠状病毒通过S蛋白-ACE2结合途径对人类传播构成了重大的公共卫生风险。还需要提醒人们,冠状病毒跨物种或人际传播的风险和动态也受许多其他因素的影响,例如宿主的免疫反应,病毒复制效率或病毒突变率。
原文链接:
2. Origin and evolution of pathogenic coronaviruses